肠道类器官应用思路

在前几期中我们为大家介绍了小肠的结构、功能并为大家分享了肠道隐窝的分离与类器官培养方法。那么培养好的类器官都用来干嘛呢?本期将为大家提供一些肠道类器官的应用思路。
目前,类器官主要用于:
基于类器官的研究已经为阐明肠道干细胞龛复杂的调控功能做出了突出的贡献,尤其是通过类器官实验,人们发现了R-spondins的受体Lgr4和Lgr5(de Lau et al. 2011)。
类器官可用来模拟疾病,主要通过引入与疾病相关的突变来模拟功能。通过从患者身上提取细胞进行类器官培养来阐明其发病机制。近年来,肠道类器官作为囊性纤维化和结直肠癌的诊断工具受到越来越多的关注(Dekkers et al., 2016a ; van de Wetering et al., 2015 )。患者来源的肠道类器官可以重现上皮功能和基因特征,结直肠癌患者来源的类器官可展现原发肿瘤的多种生物学特征。
鉴于肠道类器官移植的可行性已被证实,肠道类器官可能成为一种治疗手段( Yui et al., 2012),这为再生医学和整合基因编辑技术的基因治疗开辟了新的可能性(Dekkers et al., 2016b)。目前肠道类器官技术依然处于快速发展阶段,基于培养流程的普及和培养成本的降低,类器官技术在研究中的应用愈加广泛,并将逐渐开始应用于新的领域。
此外,类器官以一种个体化的方式预测药物疗效,类器官技术结合高通量药物筛选,将加速检测基因-药物之间的关联性 (van de Wetering et al., 2015)。
最近几年,涉及转运体和受体的生理过程受到越来越多的关注,人们发现转运体在肠道中发挥着双向功能(Zietek and Daniel,2015)。除了具有在吸收性肠上皮细胞中的转运功能,转运体还在分泌激素的内分泌细胞的顶端膜扮演着感受器的作用(Gorboulev et al.,2012),调控肠促胰岛素释放进入血液(Diakogiannaki et al.,2013;Roder et al.,2014)。既往研究中,肠道受体也被证明具有类似的调节肠道激素分泌的功能( Reimann et al.,2012 )。肠促胰岛素GLP-1和GIP具有促进胰岛素分泌的功能,对调节血糖水平至关重要。在肠内分泌细胞中,转运体和受体作为传感器,成为2型糖尿病疗法开发中具有高度潜力的靶点(Gribble and Reimann,2016;Zictek andDaniel,2015)。
在肠上皮细胞的营养、药物的吸收功能和内分泌细胞的激素分泌功能等方面(Petersen et al. ,2014;Schweinlinet al.,2016;Zietek et al., 2015 )。这些过程与营养吸收障碍疾病、药物检测和代谢紊乱疾病(如肥胖或2型糖尿病)高度相关,由于肠道类器官可以呈现体内组织结构的重要特点,因此它成为高度分化的、功能健全的肠上皮细胞的良好来源。
除此之外,通过利用特定的调节因子如γ-分泌酶抑制剂,类器官还可富集肠道稀有细胞类型,如肠内分泌细胞,其在正常生理条件下仅占肠上皮细胞的1%(Petersen et al.,2015)。以此为基础的类器官培养将极大地促进实验技术的发展,对科学研究具有深远的影响。

用于肠道营养研究的类器官模型
研究证实,肠道类器官包含肠上皮的所有细胞类型(Sato et al.,2009;Spence et al., 2011),包括分泌GIP和GLP-1的肠内分泌细胞( Petersen et al.,2014;Petersen et al. 2015)。类器官可来自小鼠或人的肠道组织,用标准的细胞培养皿培养,并可在实验室通过传代培养数月,因此,最近研究者在探究小鼠肠道类器官是否可以成为用于肠道转运、感知和激素分泌研究的体外模型(Zietek et al.,2015),由于肠道营养转运体特异性表达于膜的顶部或基底外侧,因此类器官的上皮包含极化的肠上皮细胞。研究发现,许多营养转运体,如SGLT1、PEPT1或GLUT5,均表达于面向肠腔的顶端膜,以从消化的食物中吸收营养(Daniel and Zietek,2015)。然而,其他一些营养转运体,如氨基酸转运体或GLUT2,则表达于基底膜,从而介导来自肠上皮细胞的养分进入血液循环(Roder et al. 2014),因此,保证目的转运蛋白定位在肠道类器官的正确位置是非常重要的。
在研究特定激素分泌时,确保类器官培养中包含肠内分泌细胞亦非常必要,最简便的方法便是将类器官包埋于石蜡中,进行免疫荧光检测。在研究转运蛋白(或其它肠道蛋白)时,推荐利用缺乏目的蛋白表达的敲除小鼠进行类器官培养来验证染色的特异性。根据不同的目的蛋白,在构建类器官时选择正确的部位较为关键,肠道部位与肠道激素分泌的研究也同样相关,不同亚型的肠内分泌细胞分布在肠道的不同部位。值得注意的是,从近端小肠到远端小肠,分离所得到的隐窝明显减少,培养所得到的类器官也明显减少。在研究营养感知时,如果所研究的传感器蛋白的表达位置与目标肠内分泌细胞亚型的分布位置不同则需要做出折中。
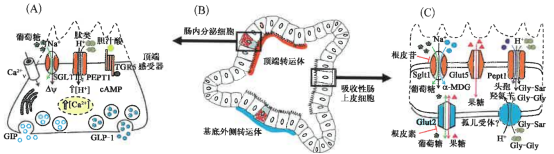
类器官用于肠道转运、感知、激素分泌示意图
宿主-微生物相互作用是指微生物(如细菌、寄生虫、病毒)与宿主(如人类、动物)之间发生的相互作用,宿主-微生物相互作用的研究需要合适的模型系统来模拟体内感染。在过去的几十年里,研究者们采用了各种体内外实验模型来研究宿主与微生物的相互作用,这些模型的最终目的是在体外创建一个能够模拟人体真实情况的环境,以阐明健康和疾病中宿主反应的生理机制。这些模型包括来源于人或动物细胞的细胞培养系(Dingli and Nowak,2006),可经口或接种感染病原体的选定动物模型(Fang et al.,2013),以及模拟宿主-细菌相互作用的类器官(Fatehullah et al.,2016)。对于某些感染因子而言,目前完全缺乏良好的模型系统,而对于另一些感染因子,现有的模型也并非最佳。
非类器官方法及类器官方法在宿主-细菌相互作用研究中的优缺点如下。
肠道上皮是成年哺乳动物中自我更新速度最快的组织,它包括一系列分化的细胞类型,每个类型都有其自身的特性。大多数用于研究沙门菌和肠道上皮细胞之间相互作用的体外模型无法重现在正常肠道中观察到的分化组织成分和结构。创建分化细胞的一种方法是通过悬浮培养技术,该技术使用旋转壁式生物反应器使细胞保持悬浮并无气泡通气,以这种方式形成的三维(3D)聚合体的特征在于具有细胞极性、细胞外基质产生和器官特异性分化。然而,该系统可能缺乏负责肠道组织更新的正常干细胞生态位(Zhang et al.,2014)。
新近发展起来的类器官模型充当了体内外系统之间的桥梁,Ootani等报道了一种复杂的培养体系,即在基质细胞的支持下,将整个肠组织切片包埋在3D胶原结构中(Ootani et al.,2009)。Sato及其同事建立了一个相对简单的类器官培养系统,使用基质胶作为ECM替代品,并辅以构成关键内源性生态位信号的生长因子。该系统已被用于创建具有明显隐窝和绒毛样结构域的三维结构,该结构与中央管腔相邻,其中包含从不断更新的上皮层中挤出的死细胞(Sato et al.,2009)。类器官如实再现了体内上皮结构,并包含完整的干细胞、祖细胞和分化细胞类型(Fatehullah et al.,2016;Sato et al.,2009)。此后,肠道类器官被用于基础和临床研究的各个方面,包括用于产生人肠道类器官,以及用于从具有不同遗传修饰的动物模型中产生类器官。

利用来源于隐窝的小鼠肠道类器官,研究者能够直观观察鼠伤寒沙门菌的侵袭性以及类器官的形态变化(Zhang et al.,2014)。在类器官中,结构域与中央管腔相邻,中央管腔含有从不断更新的上皮层挤出的死细胞,研究者利用致病性伤寒沙门菌14028S(10°CFU)定植感染培养物。第一个30min的孵育使细菌接触到类器官细胞表面,30min后,用Hank's平衡盐溶液(Hank's balanced salt solution,HBSS)洗去细胞外细菌。之后,将受感染的类器官在含有庆大霉素的培养基中培养1h。研究人员发现细菌感染显著抑制了类器官的生长,包括出芽和类器官培养物的总面积。鼠伤寒沙门菌进入类器官的上皮细胞,导致紧密连接的破坏。例如,在沙门菌感染的类器官中,紧密连接(tight junction,TJ)蛋白ZO-1染色减少并断开连接(图13.1)。有趣的是,TJ蛋白Claudin7似乎没有受到影响。
在感染沙门菌的类器官中检测了基于NF-kB通路激活的炎症反应。沙门菌感染的类器官中总kBα显著减少,磷酸化IkBα增加,磷酸化NF-kB p65也有所增加。通过共聚焦显微镜观察,研究人员发现NF-kB p65已转移到感染沙门菌的类器官的细胞核中。作为NF-kB激活的下游靶点,与没有任何感染的类器官相比,受感染类器官中的炎性细胞因子(例如,IL-2、IL-4、IL-6和TNF-a)显著增加,而且,ELISA对沙门菌感染后1h培养液中IL-6蛋白的检测灵敏度足够高。感染1、2、4h后,培养基中的ⅡL-6 蛋白显著增强(Zhang et al.,2014)。此外,western blot、PCR和免疫荧光数据表明,沙门菌感染(使用GFP标志的Lgr5类器官)显著降低了干细胞标志物(Lgr5和Bmil)。
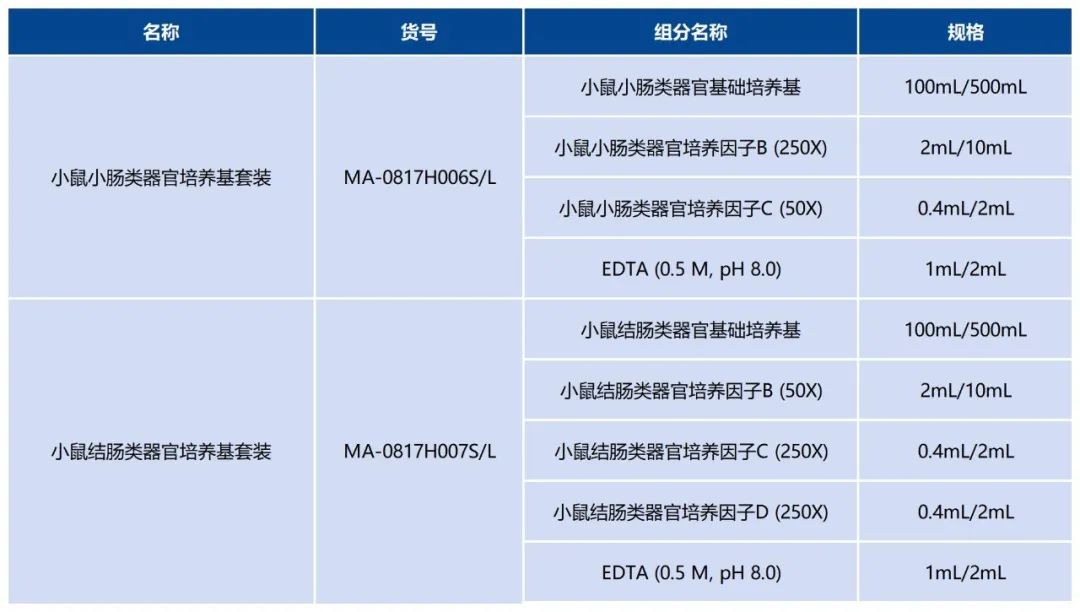
小鼠肠道类器官培养基套装推荐
因此,研究者首次建立了一个体外模型系统,再现了沙门菌感染肠道的体内研究中的一些观察结果,包括沙门菌入侵、紧密连接结构破坏、炎症细胞因子增加以及宿主-细菌相互作用期间干细胞标志物减少等。该研究证明,沙门菌感染的类器官培养系统是研究宿主-细菌相互作用的一种全新的、可行的实验工具。
Forbester等利用来源于人诱导多能干细胞(human induced pluripotent stem cells, hiPSCs)的肠道类器官(intestinal organoids,iHOs)(Forbester et al.,2014;Forbester et al. 2015),建立了类器官腔内微量注射鼠伤寒沙门菌的方法。RNA测序显示,与对照组相比,感染了鼠伤寒沙门菌的肠道类器官中1448个基因显著上调、577个基因显著下调;上调的基因包括编码促炎细胞因子的基因,如CCL20、IL1B和IL23A等。利用缺失SPI-1 Ⅲ型分泌系统中invA组分的鼠伤寒沙门菌突变株,Forbeste等证明该系统可用于功能性评估特定突变体的发病机制(Forbester et al.,2014;Forbester et al.,2015)。
显微注射含细菌的类器官可以在相对可控的环境中模拟细菌感染,在没有免疫细胞或共生菌引入混杂变量的情况下,可以直接检测病原体与上皮细胞的相互作用。Wilson等报道,野生型小鼠和Mmp7小鼠类器官中的Paneth细胞产生含有α-防御素的颗粒。
类器官形成一个密闭的管腔,其中含有一定浓度的α-防御素,能够在感染后至少20h内限制鼠伤寒沙门菌的生长( Wilson et al.,2015)。
除了致病性细菌研究外,类器官还可用于共生菌、益生菌以及微生物组学研究。例如,离子组成和pH的区域特异性变化与管腔和黏膜相关细菌的区域特异性改变相关,一般来说,厚壁菌门(Firmicutes)普遍减少,而拟杆菌门(Bacteroidetdes)成员增加(如多形拟杆菌)(Engevik et al.,2013)。在野生型和NHE3末端回肠类器官中接种多形拟杆菌均显示fut2和岩藻糖基化增加。这些数据表明,单独的多形拟杆菌足以在体内观察到增加的岩藻糖基化(Engevik et al.,2013)。
文章1:Recapitulating macro-scale tissue self-organization through organoid bioprinting
文章简介:开发了一种生物打印辅助的组织形成方法,通过3D生物打印引导控制几何形状和细胞密度形成具有自组织特征的纳米级组织,可形成类似肠胃交界处的组织。
文章2:Establishment of intestinal organoid cultures modeling injury-associated epithelial regeneration
文章简介:提出了一种构建研究肠上皮损伤后再生的类器官模型,并揭示了两种表观遗传调节因子在调控肠道损伤后再生过程中的关键作用和机制的方法。
作为“万病之源”,所有已知的人类疾病中高达90%都可追溯道不健康的肠道。因此,肠类器官并不局限于肠道疾病研究。
文章1:Co-emergence of cardiac and gut tissues promotes cardiomyocyte maturation within human iPSC-derived organoids
文章简介:证明了类器官中内胚层组织(肠)的存在有助于心脏管形成后阶段特征的心脏组织特征的发展,包括心肌细胞扩张、区室化、心房/淋巴结细胞富集、心肌压实和胎儿样功能成熟。总体而言,这项研究证明了在单个类器官模型中产生和成熟来自不同种谱系的合作组织的能力,这一进展将进一步检查发育,生理成熟和疾病过程中的多组织相互作用。
文章2:The Intestinal Microbiota Modulates the Anticancer Immune Effects of Cyclophosphamide
文章简介:环磷酰胺改变了小肠中微生物群的组成,并诱导选定的革兰氏阳性细菌物种易位到次级淋巴器官。以此表明肠道微生物有助于抗癌作用。
文章3:A gut-secreted peptide suppresses arousability from sleep
文章简介:高等肠道中的蛋白质浓度导致肠内分泌细胞活性增加释放肽CCHa1,CCHa1向一小群多巴胺神经元发出信号在大脑中调节其活动;多巴胺能活性调节行为动物对振动的反应。
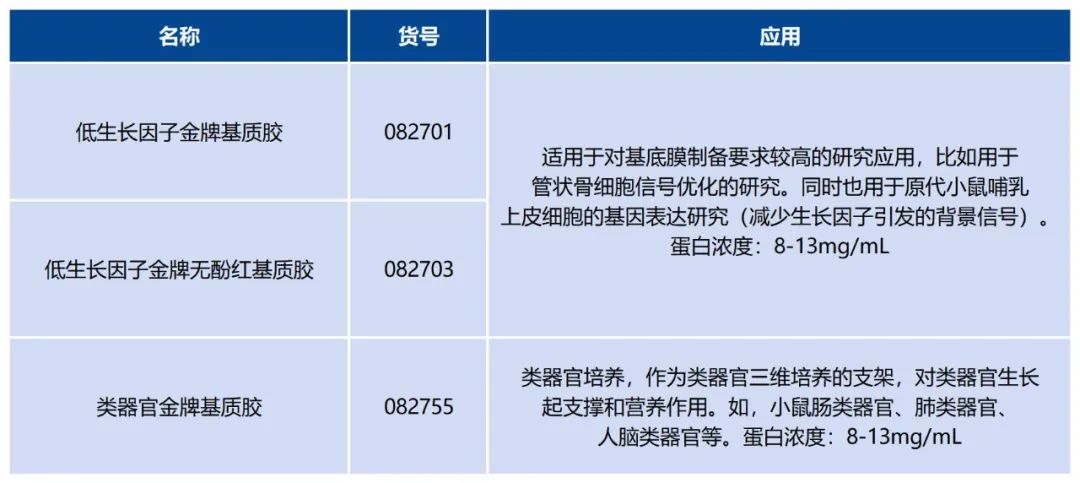
类器官专用基质胶推荐
厦门模基生物科技有限公司(Xiamen Mogengel)位于中国·厦门国家高新技术创业中心。公司致力于3D细胞培养核心原材料的研发与产业化升级。目前公司的产品有基质胶、类器官培养基、细胞因子、3D细胞培养耗材、3D细胞培养智能显微镜等。公司拥有4大技术研发中心:分子克隆和细胞编辑中心、实验动物中心、蛋白表达和纯化平台、类器官质检系统和自动化。
团队拥有十余年类器官技术研究基础,实力雄厚,科研意志坚定,学术态度严谨,大胆尝试,勇于创新。公司推出的基质胶、类器官培养试剂盒等产品广泛适用于类器官培养、血管生成实验、细胞侵袭(transwell)实验、PDX、CDX模型实验、肿瘤球培养、肿瘤移植、皮下成瘤实验、干细胞培养及细胞分化研究以及其他待开发实验类型。